Ganhe uma renda extra trabalhando pela internet
Descubra como aumentar seus rendimentos realizando tarefas simples no conforto de sua casa. Junte-se a milhares que já estão aproveitando estas oportunidades.
Introdução
A cor da chama é um fenômeno fascinante que pode ser observado em diferentes contextos, como em fogões, velas e outros sistemas de combustão. Essa característica visual não apenas possui um apelo estético, mas também fornece informações valiosas sobre o processo de combustão e as propriedades dos combustíveis utilizados. Neste artigo, exploraremos o fenômeno da cor da chama a partir de uma perspectiva física, compreendendo as bases científicas envolvidas.
Composição da Chama e Emissão de Luz
Para entender a cor da chama, é essencial considerar a composição dos combustíveis utilizados. A maioria das chamas é formada por hidrocarbonetos, compostos químicos constituídos principalmente por carbono e hidrogênio. Durante a combustão, os átomos de carbono e hidrogênio reagem com o oxigênio presente no ar, liberando energia na forma de calor e luz.
A cor da chama está diretamente relacionada à emissão de luz pelos elementos presentes na chama. Os elétrons dos átomos presentes nos gases da chama podem absorver energia térmica durante o processo de combustão e são excitados para níveis de energia mais elevados. Quando esses elétrons retornam aos níveis de energia fundamentais, eles emitem energia na forma de luz visível, gerando a coloração característica da chama.
Relação entre Composição Química e Cor da Chama
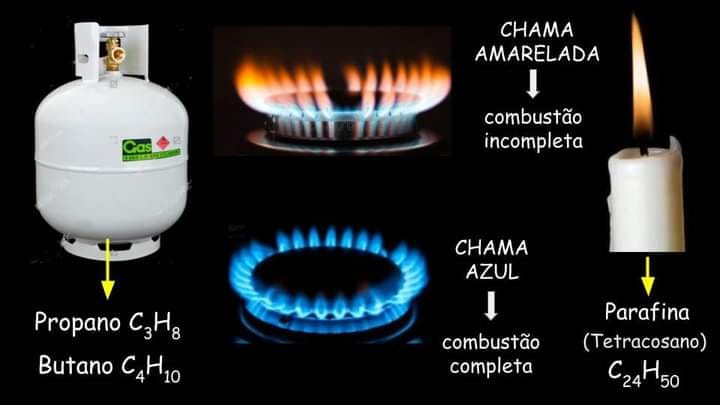
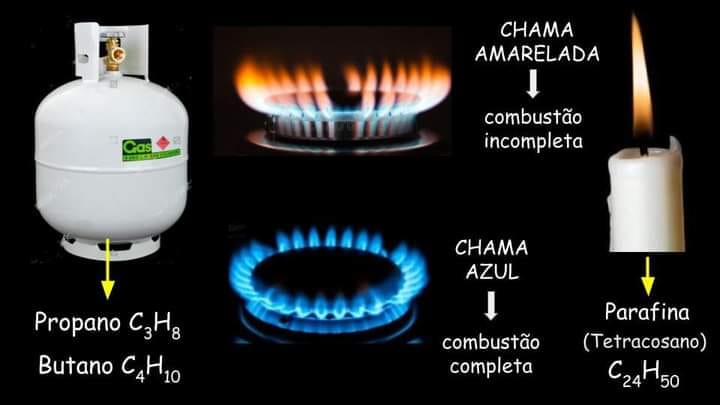
A composição química dos combustíveis utilizados desempenha um papel crucial na determinação da cor da chama. Vamos explorar duas situações comuns: o gás de cozinha (GLP) e a parafina.
-
Gás de Cozinha (GLP)
O gás de cozinha, também conhecido como GLP (gás liquefeito de petróleo), é composto principalmente por butano (C4H10) e propano (C3H8). Essas moléculas possuem uma estrutura simples, com poucos átomos de carbono. Durante a combustão completa do GLP, ocorre uma reação eficiente, liberando uma grande quantidade de energia térmica. Essa combustão completa resulta em uma chama com uma coloração azul intensa, indicando a presença de átomos excitados, principalmente de carbono.
-
Parafina
A parafina, utilizada como combustível em velas, é uma mistura de hidrocarbonetos com cadeias carbônicas mais longas, contendo muitos átomos de carbono, como o tetracosano (C24H50). Devido à complexidade dessas moléculas, a combustão completa não é facilmente alcançada, especialmente em ambientes com uma oferta limitada de oxigênio. Como resultado, a reação de combustão ocorre de maneira incompleta, gerando uma chama amarelada. Essa cor está relacionada à emissão de luz pelos átomos excitados na chama, principalmente carbono e hidrogênio.
Emissão de Luz e Espectro Eletromagnético
A luz emitida pela chama é composta por diferentes comprimentos de onda, abrangendo uma gama de cores no espectro visível. Cada cor corresponde a um comprimento de onda específico e pode ser separada utilizando técnicas como a dispersão da luz por meio de um prisma. A separação das cores revela um espectro contínuo, mostrando a distribuição de energia em diferentes comprimentos de onda.
A cor predominante da chama depende dos elementos químicos presentes, suas energias de excitação e transições eletrônicas correspondentes. Átomos de diferentes elementos emitem luz em comprimentos de onda característicos, o que permite identificar os elementos presentes na chama por meio de técnicas espectroscópicas.
Importância das Observações da Chama
A análise da cor da chama tem implicações práticas em várias áreas. Por exemplo, em sistemas de aquecimento e fogões, uma chama azul é geralmente desejada, pois indica uma combustão completa e eficiente, minimizando a emissão de poluentes. Uma chama amarela pode indicar uma combustão incompleta, o que requer ajustes no sistema ou a solicitação de assistência técnica.
Além disso, a análise da cor da chama pode ser útil em laboratórios e indústrias. Por meio de técnicas espectroscópicas, é possível identificar elementos presentes na chama e obter informações sobre a composição química dos combustíveis utilizados. Essa análise contribui para a segurança e o controle de qualidade em diversos processos.
Outras Cores de Chama
As cores das chamas podem variar dependendo dos elementos químicos presentes na combustão. Aqui estão algumas das cores mais comuns associadas a diferentes elementos:
- Azul: A chama azul é geralmente observada em queimas de gás natural ou de gases contendo hidrogênio. A cor azul indica uma combustão eficiente, na qual há uma quantidade suficiente de oxigênio disponível para queimar completamente o combustível.
- Amarelo: A chama amarela é comum em queimas de materiais como madeira, papel ou ceras. Esses materiais contêm carbono e, quando a combustão não é completa, partículas de carbono são liberadas, causando a cor amarela.
- Vermelho: A chama vermelha pode ocorrer em temperaturas mais baixas. É frequentemente observada em queimas de materiais ricos em fósforo ou em compostos químicos que contêm esse elemento.
- Branco: A chama branca é resultado da combustão completa do combustível, quando todas as cores do espectro são emitidas. É comumente vista em queimas de gás natural e outras substâncias onde a proporção de oxigênio é adequada.
- Verde: A chama verde pode ocorrer quando há a queima de materiais que contêm cobre, como compostos químicos contendo esse metal. É possível obter uma chama verde adicionando sais de cobre à combustão.
- Roxo ou Violeta: A chama roxa ou violeta é característica da queima de elementos como o potássio ou o lítio. Esses elementos emitem radiação na faixa do espectro visível correspondente à cor roxa.
Vale ressaltar que as cores das chamas podem ser influenciadas por outros fatores, como a temperatura, a pressão e a composição do ambiente. A observação das cores das chamas pode ser utilizada em várias áreas, como a química, a física e a segurança, para identificar elementos e monitorar processos de combustão.
Referências:
- Rocha-Filho, R. C. et al. (2007). Espectroscopia: Fundamentos e Aplicações. Editora Livraria da Física.
- Ziółkowski, M. (2013). Color and Light in Nature. CRC Press.
- Lindner, M. (2018). Combustion Phenomena: Selected Mechanisms of Flame Formation, Propagation and Extinction. Springer.